Bài viết này Pharma Labs sẽ chia sẻ cho các bạn kiến thức về “Cách kiểm tra tài liệu Dược chất và mua Dược chất” đối với các dược chất có thể mua trong nước và nhập khẩu.
Bắt đầu tìm hiểu về cách kiểm tra tài liệu dược chất và cách mua nào:
Việc đầu tiên, cần xác định dạng của dược chất: Dạng base, acid hay dạng muối; dạng khan hay dạng ngậm nước – và ngậm bao nhiêu phân tử nước. Từ đó sẽ yêu cầu các nhà cung cấp gửi tài liệu đúng với dược chất mình yêu cầu.
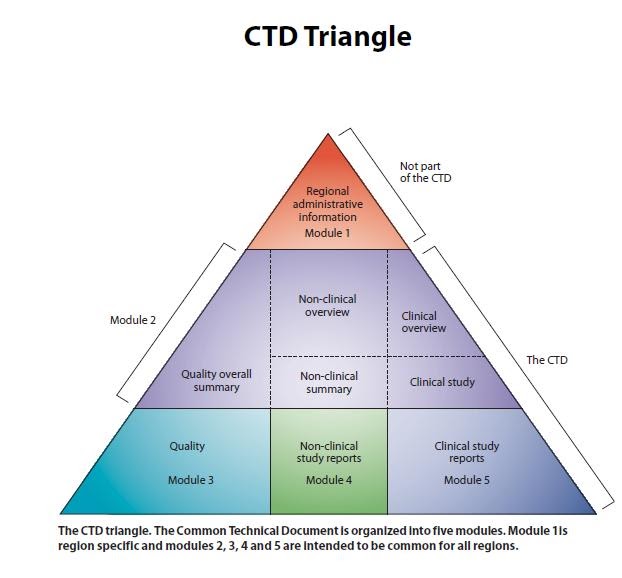
Nhưng trước khi nhận tài liệu để kiểm tra thì các bạn phải hiểu được 1 bộ tài liệu của dược chất gồm những gì đãng. Bộ tài liệu được sử dụng theo định dạng chung của thế giới CTD (Common Technical Document). CTD gồm 5 Module như hình vẽ bên dưới, trong đó:
Module 1. Thông tin quản lý (Administrative information) hay còn gọi là phần hồ sơ hành chính đối với hồ sơ Việt Nam theo chuẩn ACTD: Module này không cần quan tâm và thường thì nhà sản xuất cũng không cung cấp các tài liệu này.
Module 2. Tóm tắt tài liệu kỹ thuật chung (Common Technical Document Summaries): Phần này chỉ là tóm tắt của Module 3 nên họ cũng sẽ không cung cấp.
Module 3. Phần hồ sơ chất lượng, là phần quan trọng nhất và nhà sản xuất phải cung cấp tài liệu cho mình. Nó bao gồm 2 phần: Phần S (từ 3.2.S.1 tới 3.2.S.7) là về dược chất, Phần P (Từ 3.2.P.1 tới 3.2.P.8) là về thành phẩm. Ở đâu chỉ nói về dược chất nên Nhà sản xuất sẽ cung cấp phần S cho mình kiểm tra.
Module 4 là nghiên cứu không phải lâm sàng và Module 5 là các nghiên cứu lâm sàng. 2 phần này Nhà sản xuất sẽ không gửi, và cũng không cần tới.
Bước 1. Kiểm tra phiếu kiểm nghiệm
Bên nhà cung cấp (vendor) sẽ cung cấp các phiếu kiểm nghiệm (COA) của sản phẩm (có thể cung cấp kèm các tài liệu liên quan (open part) như: chứng chỉ của nhà máy (GMP), chứng nhận của sản phẩm (CEP,CPP …), Tiêu chuẩn và phương pháp (analytical procedure) để bên nghiên cứu đánh giá, Độ ổn định của dược chất (stability). Bên nghiên cứu sẽ đánh giá xem COA này có đạt yêu cầu hay không. Tùy từng COA của nhà sản xuất (manufacturer), tùy từng tiêu chuẩn nhà sản xuất đã công bố trong COA mà sẽ xác định xem COA đạt theo 1 tiêu chuẩn dược điển (Pharmacopoeia), theo 1 tiêu chuẩn dược điển + chỉ tiêu nhà sản xuất (in-house), theo nhiều dược điển hoặc đạt theo tiêu chuẩn nhà sản xuất. Để kiểm tra được 1 COA đạt hay không, các bạn tham khảo theo video hướng dẫn này của Pharma Lab nhé:
Bước 1 hoàn thành khi bạn tìm được COA đạt tiêu chuẩn của 1 hoặc vài nhà sản xuất khác nhau.
Bước 2: Kiểm tra độ ổn định
Sau khi đã kiểm tra được COA, hãy tiến hành kiểm tra tới phần 3.2.S.7. Stability: Độ ổn định. Độ ổn định sẽ nghiên cứu ở 2 điều kiện là lão hóa cấp tốc (accelerated condition) và điều kiện dài hạn (long-term condition) với sự kiểm soát nhiệt độ và độ ẩm khác nhau.
Cách kiểm tra phần S.7 như sau:
- Độ ổn định cấp tốc phải đủ dữ liệu trong 6 tháng.
- Độ ổn định dài hạn phải đủ dữ liệu tới đủ hạn dùng: 24, 36, 48 … tháng
- Các chỉ tiêu theo dõi là một số hoặc hầu hết các chỉ tiêu có trong COA. Những chỉ tiêu bị thay đổi khi dược chất bị hỏng, bị phân hủy. VD. Hàm lượng, Tạp chất liên quan, Hàm ẩm ….
Nếu độ ổn định thấy thiếu dữ liệu ở các mốc thời gian thì yêu cầu bổ sung. Các chỉ tiêu theo dõi khác với COA thì yêu cầu gửi lại.
Bước 3: Kiểm tra phần kiểm soát dược chất (3.2.S.4. Control of Drug Substance)
Thường thì phần S.4. NSX sẽ không cung cấp ngay phần 3.2.S.4.3. Validation of Analytical Procedures (thẩm định quy trình phân tích). Chỉ khi ký giấy cam kết bảo mật dữ liệu (CDA) và/ hoặc mua nguyên liệu nghiên cứu thì bên nhà sản xuất mới gửi tài liệu còn lại cho mình (close part).
Tiến hành kiểm tra phần này như sau:
- COA theo 1 tiêu chuẩn dược điển: Kiểm tra lại Phương pháp phân tích (3.2.S.4.2. Analytical Procedure) có đúng theo dược điển tham chiếu không, không cần kiểm tra phần thẩm định phương pháp phân tích (3.2.S.4.3. Validation of Analytical Procedure).
- COA theo 1 tiêu chuẩn dược điển + chỉ tiêu nhà sản xuất (in-house): Kiểm tra tương tự như trên. Nếu chỉ tiêu ngoài liên quan đến xác định hàm lượng, phương pháp chạy cần phải thẩm định (như chạy HPLC) thì cần yêu cầu Nhà sản xuất cung cấp phần 3.2.P.4.3. Thẩm định để mình đánh giá. Phần 3.2.P.4.3. sẽ gồm 3 phần chính: 1 là Đề cương (protocol), 2 là Báo cáo (report) và 3 là dữ liệu thô (ví dụ như sắc ký đồ, kết quả phổ …). Nếu đầy đủ thì nguồn nguyên liệu này oke.
- COA theo nhiều dược điển: Kiểm tra tương tự như với 1 dược điển và có lưu ý như sau. Với chỉ tiêu trùng nhau giữa các dược điển, mà phương pháp kiểm tra của chúng khác nhau, thì cần có tất cả các phương pháp theo các dược điển khác nhau của chỉ tiêu này trong 3.2.S.4.2.. Ví dụ: Chỉ tiêu định lượng của nguyên liệu A (Nguyên liệu A đạt theo USP và BP) trong USP yêu cầu chạy HPLC, trong BP yêu cầu chạy UV-VUS, thì trong phần 3.2.S.4.2. Phương pháp phân tích cần có cả 2 phương pháp này. Nếu chỉ có định lượng theo HPLC thì nguyên liệu A chỉ đạt theo USP mà thôi, mặc dù tiêu chuẩn định lượng vấn để từ 98 – 102%.
- COA theo tiêu chuẩn nhà sản xuất: Tất cả các chỉ tiêu cần thẩm định (như định lượng, độ hòa tan, tạp chất liên quan, dung môi tồn dư …) đều cần có hồ sơ thẩm định phương pháp 3.2.S.4.3. Bao gồm: Đề cương, Báo cáo và dữ liệu gốc (Sắc ký đồ).
Một bộ tài liệu dược chất được coi là lý tưởng nhất khi nhà sản xuất cung cấp toàn bộ tài liệu liên quan đến sản phẩm DMF (drug master file). Nhưng đa số là sẽ không cung cấp hết, vì nó sẽ làm lộ các bí mật sản xuất của họ. Do đó phải yêu cầu nhà sản xuất gửi tối thiểu các tài liệu cần thiết để nộp hồ sơ đăng ký. Để biết với các trường hợp khác nhau cần phải cung cấp tài liệu gì thì bạn có thể tham khảo và làm theo theo hướng dẫn trong Video sau đây của Pharma Labs:
Bước 4: Mua dược chất và tiếp tục xin bổ sung các tài liệu còn thiếu.
Tiến hành mua nguyên liệu về phục vụ nghiên cứu đối với những nguồn đạt về mặt tài liệu hoặc nguồn dược chất có thể cung cấp thêm các tài liệu còn lại. Trong thời gian đó, tiếp tục xin các tài liệu còn lại của dược chất (MOA, Stability, validation… theo form CTD hoặc DCTD).
Bước mua dược chất sẽ liên quan tới mua hàng và xin giấy phép nhập khẩu, ký cam kết bảo mật dữ liệu (CDA) và các thủ tục hải quan khác, mình sẽ không nói tới trong tài liệu này.
Trên đây là bài chia sẻ về cách đánh giá tài liệu dược chất và mua dược chất của Pharma Labs, các bạn thấy hay thì nhớ like và share nhé. Cảm ơn các bạn đã đồng hành cùng Pharma Labs

https://www.facebook.com/pharmalabs.rd
https://www.youtube.com/channel/UCzDND2lXy7whjG4UVauDvBA